원소주기율표 분석하기 #2/3
이전글 : 원소주기율표 분석하기 #1/3
다음글 : 원소주기율표 분석하기 #3/3
앞 글에서 원자껍질에 대한 몇몇 규칙과 껍질마다 들어갈 수 있는 전자의 최대 개수에 대해서 살펴봤다. 이 글에서는 앞서 설명한 규칙들이 실질적으로 어떻게 사용되는지에 대해 살펴 보자. 앞서 살펴본 규칙이 어렵지, 그것만 이해한다면 원소주기율표는 비교적 쉬울 것이다.
1. 원소주기율표의 기본적 생김새
110 번 원소까지 나타낸 기본적인 원소주기율표 모양이다. (이 글을 쓸 당시까지만 해도 110 번 이후는 불분명하다고 평가되고 있었으나 지금은 120 번(Ubn 또는 Unun)까지 발견됐다.) 왼쪽과 오른쪽 가장 높은 곳이 2 칸이고, 그 밑의 층을 이루는 칸이 6 개 추가된다. 가장 밑 부분의 칸은 10 개가 추가되고, 또다시 그 밑의 칸은 14 개가 추가되는데 이는 각각의 원자부껍질에 들어가는 전자의 수와 일치한다. 이는 나중에 다시 살펴보기로 하고…. 일단은 다른
성질부터 살펴보자.
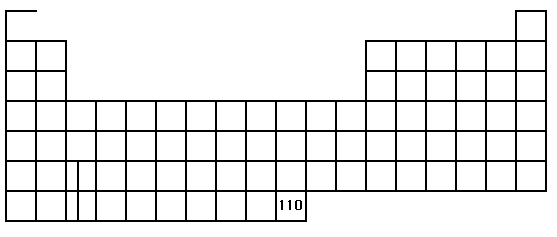
원소주기율표의 기본적인 설명을 붙여봤다. 1A부터 0까지 각각 세로줄 위에 써 있는 이름은 1부터 18까지로 부르기도 한다. 그때그때 적절히 부르면 된다. 그림에 써놓았듯이 1A족 첫 번째 원소 칸인 수소(H)의 오른쪽 선은 지워져 있어야 한다. 수소의 성질은 1A족과 같지만, 때때로 7B족과 같을 수도 있기 때문이다.
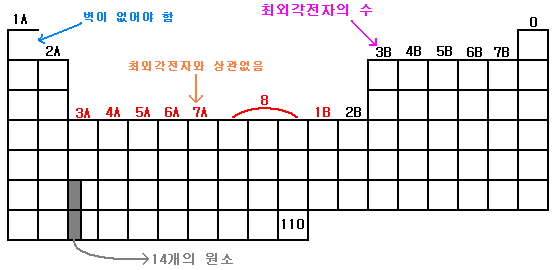
- 맨 위에 0이라고 쓴 세로줄은 0족[8족] 원소로 이루어진 불활성 기체족이다. 기본적으로 다른 원자와 화합물을 만들지 않는다. 앞 글에서 멘델레예프가 처음 주기율표를 만들 때는 알려지지 않은 족이라는 설명을 한 바 있다.
- 1A의 알칼리족과 2A의 알칼리토금속족은 s 부껍질을 채우는 순서의 원소로 이루어져 있다. 원자가전자가 1~2 개 뿐이어서 전자를 잘 잃어버린다.
- 3B~7B는 p 부껍질을 채우는 순서에 있는 원소들로 이루어져 있다. 훈트의 규칙에 따르는 약간 예외인 원소도 있다. 이는 복잡하니 세 번째 글에서 살펴보도록 하자.
- 3A~1B와 검정색인 2B는 d 부껍질을 채우는 순서의 원소로 이루어져 있다. 1B족까지를 우리는 전이원소라고 부른다. 이들은 화학적 성질과 물리적 성질이 매우 유사하다. 그래서 정제하기가 매우 어렵다. 족 이름을 빨간 색으로 표시한 것은 최외각전자와 족 이름의 숫자가 일치하지 않는다는 것을 뜻한다.
가로줄은 최외각전자의 주양자수를 나타낸다. 여기서 최외각전자의 주양자수가 기준이 되는 것은 부양자수는 꼭 그 줄에서 따르지 않아도 된다는 것을 의미한다.
2. 원소의 크기
이번 그림에서는 원자 크기 변화를 보여준다. 멘델레에프가 원소주기율표를 처음 만들 때 원자 크기가 가장 중요한 기준이었다. 따라서 이 그림은 많이 중요하다. 참고로, 원자 크기는 가장 큰 프란슘(Fr)부터 가장 작은 불소(F)까지 크기가 3 배 이하로 차이난다는 것에 주의해야 한다. 즉 3번 원소 리튬(Li)과 우라늄(U) 크기는 비슷하다.
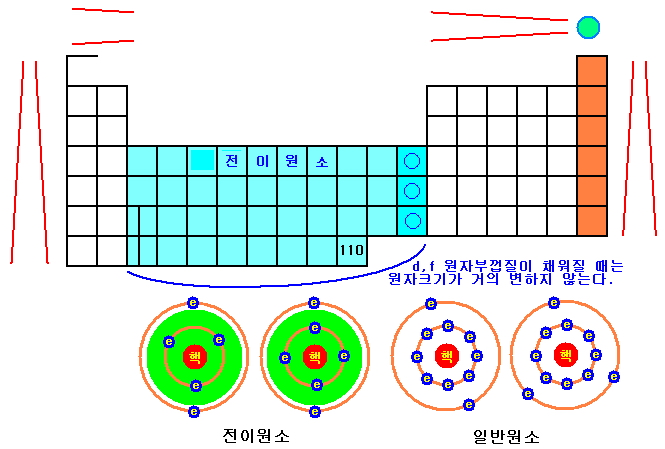
① 한 가로줄의 원소 크기 변화
우선 가로줄은 오른쪽으로 갈수록 원자들이 작아진다. 그에 다한 설명은 일반원소의 그림을 보면 이해가 쉬울 것이다.
원자 중심에 양전하를 띄는 원자핵이 있고, 주변을 음전하를 띄는 전자가 있다. 원자 크기는 대략 원자핵과 최외각전자가 잡아다니는 쿨롱의 힘에 의해서 결정된다. 전자 개수와 원자핵의 양전하 개수는 항상 같으므로 무거운 원자는 주변 전자를 더 강하게 잡아다녀 크기가 작다. 따라서 원자껍질 조건이 비슷한 한 가로줄만 살펴본다면, 오른쪽에 위치한 원소가 왼쪽에 위치한 것보다 원자번호가 크므로 원자 크기가 작다.
그러나 0족 원소는 이 규칙을 따르지 않는다. 최외각전자가 8 개(헬륨은 2 개)가 되면 전자가 서로 반발하는 힘이 원자핵과의 쿨롱의 힘보다 더 큰 영향을 준다. 그래서 0족 원소는 가운데 위치한 원소와 크기가 비슷하다.
② 한 세로줄의 원소 크기 변화
하늘색으로 칠해진 전이원소는 최외곽 원자껍질의 s 원자부껍질이 다 찬 상태에서 안쪽 원자껍질의 d나 f 원자부껍질을 채우는 순서의 원소이다. 결국 원자껍질의 전자와 원자핵의 양성자가 하나씩 늘어나도 최외각전자가 원자핵과 잡아다니는 쿨롱의 힘은 모두 비슷할 것이다. 더 작은 원자껍질에 있는 전자가 큰 원자껍질에 있는 전자와 반발하여 원자핵의 양성자 한 개가 만드는 쿨롱의 힘을 상쇄하기 때문이다. 이를 가림 효과라고 하는데, 고전역학 모형인 보어 원자모형으로 계산한 값이 양자역학 모형인 슈뢰딩거 원자모형으로 계산한 값보다 대략 10% 정도 더 크게 계산된다. 고전역학에서는 바깥 원자궤도의 전자가 안쪽 원자궤도의 전자보다 원자핵에 가까이 가지 않는데, 양자역학 확률분포는 순서가 뒤바뀔 확률이 존재하기 때문이다.
세로줄에서는 밑의 원소가 더 큰데, 주양자수가 커지면 공명 진동수(=껍질 수)가 많아지기 때문이다.
3. 원자 부껍질에 전자가 채워지는 순서
원자부껍질에 대해서 알아보기 위해서 원소주기율표를 잠시 변형시켜 보자. 이렇게 바꿀 때는…. 주의할 중요한 점이 존재하는데… 이 글에서는 생략한다. 주의할 점을 알아야 할 때는 이미 그에 대해서 알고 있게 될 것이라고 생각한다.
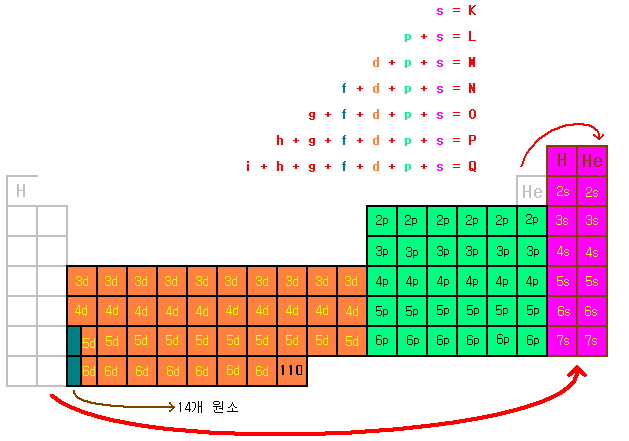
색으로 칠한 영역별로 살펴보면 보라색으로 되어있는 부분은 s 원자부껍질을, 녹색으로 칠해져 있는 부분은 p 원자부껍질을, 주황색으로 칠해져 있는 부분은 d 원자부껍질을, 풀색으로 칠해진 부분은 f 원자부껍질을 채운다. 색깔별 변화 수는 2, 6, 10, 14인데, 이 변화 규칙은 각 원자부껍질에 들어가는 전자 개수와 일치한다.

각 칸에는 필요한 주양자수와 원자부껍질을 적어놨다. 한 줄에서는 오른쪽에 위치한 칸이 왼쪽에 위치한 칸보다 항상 주양자수가 큼에 주의해야 한다. 가장 오른쪽 s 원자부껍질 칸은 원래는 한칸 밑의 가장 왼쪽에 위치해야 하므로 p 원자부껍질(녹색 부분)과 같은 주양자수를 가진다. 최외각전자가 변할 수 있다.
주기율표 위의 각 원자껍질별로 원자부껍질을 표시한 곳에 화살표로 그려놓은 것을 잘 봐두기 바란다. 이는 원자부껍질 사이에 에너지 순서를 나타내는 그림이다. 전자가 원자부껍질을 채울 때는 위 그림 순서대로 에너지가 낮은 것부터 채운다.
원자부껍질의 에너지 준위 순서는 글로 설명하면 어렵지만, 반복하여 숙달하면 글로 보는 것만큼 어려운 것은 아니다. 따라서 시간이 날 때마다 반복해서 해볼 필요가 있다.
다음글 : 원소주기율표 분석하기 #3/3


잘 보고 가요
그리고 개발새발 아니죠~ 괴발개발 맞습니다!
설마 이 이야기를 처음 하셨을 것이라고 믿으시는 건 아니시죠?
제 블로그에서 개발새발에 대해서 검색해서 읽어봐 주셨으면 합니다. ^^
ㅁㄴㅇㄹ
?
아이에게 도움이 많이 될 것 같습니다…감사합니다.
방문 감사합니다.